武汉合研生物医药科技有限公司
9 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0.2999999999999998
- 0.2999999999999998
- 2.3
- 2.3
公司新闻/正文
药物筛选技术中的细胞功能学研究-cell based assay
3302 人阅读发布时间:2020-06-18 12:58
现有的药物研发的文献和资料将细胞相关的功能学评价分割成一个个独立的实验技术。本文的写作目的是拟将这些细胞相关的实验技术系统化,根据细胞接收信号后引起响应的多阶段过程,系统将细胞功能学评价方法分为四类,概述下四类功能学评价的主要的实验技术,探讨下出于基础研究,靶点验证,药物筛选,功能评价,质量控制为目的地等各个药物研发阶段合适的功能学评价方法。以G-蛋白偶联受体和ADCC效应的功能学评价方法为例子,介绍下目前细胞药物筛选评价的主流技术,探讨下方法学开发基本原则
细胞的生理反应进程概述
细胞是生命活动的基本单位,以细胞为研究对象的功能学评价方法有别于在体外理想条件下的生物化学反应过程(蛋白间相互作用,酶催化反应)等,其生理反应进程为多阶段的,可能涉及到多个受体蛋白/信号通路,协同/拮抗的复杂过程。
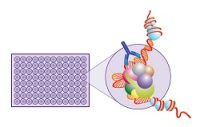
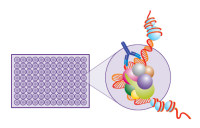
细胞单一的生理反应进程,如下图模型所示,可分为四个方面: 细胞接收外界的信号后其生理反应过程往往不是单一的,可能涉及到多条信号通路,如下图所示某RTK(受体酪氨酸激酶)激活后可能涉及到的多条信号通路,此复杂过程不是仅仅依赖基础研究的文献调研能够进行确定性区分,这需要药物研发功能学评价的研究人员通过不同的实验方法和实验结果综合评价在细胞接收信号,信号传导,引起应答整个生理反应进程中关键标志物的活性和浓度的变化,确认具体的信号通路,以及在整个复杂生理反应进程中建立起来的单一的细胞评价筛选模型是否合适,能够为后续的药物特别是新药研发服务,达到预期的使用目的。
细胞接收外界的信号后其生理反应过程往往不是单一的,可能涉及到多条信号通路,如下图所示某RTK(受体酪氨酸激酶)激活后可能涉及到的多条信号通路,此复杂过程不是仅仅依赖基础研究的文献调研能够进行确定性区分,这需要药物研发功能学评价的研究人员通过不同的实验方法和实验结果综合评价在细胞接收信号,信号传导,引起应答整个生理反应进程中关键标志物的活性和浓度的变化,确认具体的信号通路,以及在整个复杂生理反应进程中建立起来的单一的细胞评价筛选模型是否合适,能够为后续的药物特别是新药研发服务,达到预期的使用目的。
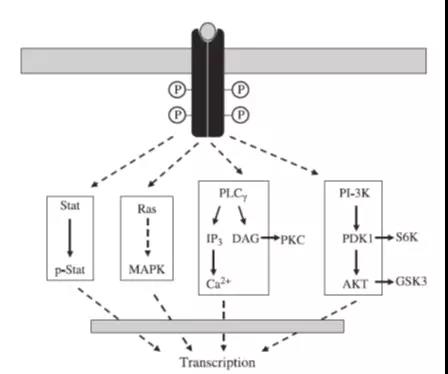
细胞功能学评价方法的分类
根据细胞单一的生理反应进程可以将细胞的功能学检测方法分为以下4类:
1.测定候选药物引起靶点蛋白最初的变化,最常见的是候选药物和位于细胞膜上的靶点受体的结合,或者阻断靶点受体和天然配体的结合,常用的检测技术包括Cell-Basd ELISA,流式细胞术进行测定候选药物-受体偶联物。有别于将靶点受体重组纯化出来进行亲和力评价,细胞膜上的靶点受体更接近真实的生理情况,位于细胞上的其他受体,效应蛋白可能会参与靶点蛋白的激活变化过程,更有参考价值。而且很多膜蛋白是多透膜结构,很难纯化得到完整三级结构构象的受体蛋白(如G蛋白偶联受体为7透膜)。
2.测定信号转导过程中信号通路中关键生物标志物的浓度,如GPCR(G-蛋白偶联受体)激活过程中第二信使cAMP, DAG, IP3(TR-FRET,ELISA)和 Ca+2 (FLIPR)的测定;关键效应蛋白磷酸化等修饰的浓度(TR-FRET,WB);关键酶酶浓度的测定;动力学转运过程的测定(内化)等。
3.对引起细胞应答的转录和翻译水平的测定。如采用实时荧光定量PCR技术对转录RNA水平的测定;采用在启动子后面插入外源的报告基因测定转录因子的活性。
4.以整个细胞为对象测定细胞的增殖或者死亡(MTT.CCK-8,c,Alarmablue,ATP测定,LDH测定),细胞的蛋白组或者基因组变化(流式测定周期凋亡),细胞的转移迁移能力变化(划痕,侵袭,transwell实验),细胞分泌物的测定如PBMC细胞的TNF和IL定量测定(ELISA,TR-FRET)。
武汉合研生物医药科技有限公司在药物筛选领域拥有丰富的技术积累,能完成各种基于细胞水平的药物筛选技术服务。
将进行细胞单一的生理反应进程的各个阶段的四类功能学实验,即接收信号(靶点蛋白结合力),信号放大(第二信使或者激酶测定),转录翻译(RT-qPCR或者报告基因),最终响应(细胞死活检测,分泌物检测),搭建完整的药物刺激后细胞响应的网络,评估靶点的有效性。在药物筛选阶段,则需要根据实验操作便捷性,选择蛋白水平的结合实验(1类)或者细胞的死活(4类)来进行药物的初步高通量筛选。功能学评价阶段最重要的是对活性比较纯的候选药物的结合力水平(1类)和最终响应水平(4类)的评估和精确的数据展现,以待建立和动物实验结果的关联。质量控制阶段则是出于方法的稳定性和精密度的需求,选择纯化蛋白水平的结合力评估(4类)和细胞功能学评估方法(2,3,4类)以备放行需要。
G-蛋白偶联受体和ADCC效应的功能学评价方法
G-蛋白偶联受体是药物研发的主要靶点之一,截止2016年FDA审批通过的1286个药物中有460个是以G-蛋白偶联受体为靶点,占1/3以上,主流的仪器试剂供应商提供了以此靶点的细胞生理反应进程各个阶段的功能学评价方法。如下图所示,在G-蛋白偶联受体激活的细胞生理反应进程能够用于功能学评价的各个关键生物标志物。G-蛋白偶联受体被候选药物激活后,G-蛋白偶联受体的细胞内部分构型发生改变使得其和G蛋白的结合力增强,G蛋白和G-蛋白偶联受体结合后,其Gα亚基活性发生改变,使得Gα亚基更加容易和GTP结合,并从其两个亚基中解离出来,Gα亚基和GTP结合后根据其类型的不同改变不同效应蛋白的活性激活下游信号的级联反应,使得第二信使的浓度发生改变,第二信使的浓度发生改变激活后续的转录因子通路,转录因子的激活调节细胞的蛋白表达,发生细胞学响应。其中G-蛋白偶联受体激活后会磷酸化,β-arrestin和磷酸化的G-蛋白偶联受体结合后介导其内化,内化的G-蛋白偶联受体重新回到细胞表面或者进入溶酶体中降解,是G-蛋白偶联受体激活后的拮抗调节通路。
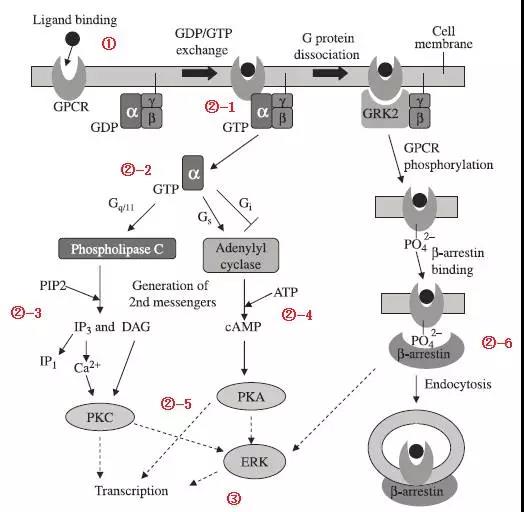
如上图所示如果按照上文所述的功能学评价的分类分为四类,以,,,进行区分,同一类别实验不同生物标志物的检测方法-1,-2等表示,以概述下主流的检测方法。
配体和受体的结合,细胞水平的亲和力评估实验。
在实际的应用过程中,特别是方法开发的初期,以细胞表面的蛋白为靶点的评价方法多采用Cell-Basd ELISA或者流式细胞技术进行亲和力测定,测定的模式可以多样,如直接法检测:将候选药物进行直接进行荧光标记检测,间接法检测:抗候选药物非靶点结合位点的荧光/酶联标记二抗进行检测(如抗人IgG1的Fc端兔抗体偶联HRP作为二抗),或者竞争法检测:将靶点蛋白的天然配体进行标记,加入候选药物进行竞争。一般来讲间接法检测和竞争法检测更具有通用性和可比性,适合多个候选药物同时进行筛选评价。需要说明的是竞争法检测针对的是候选药物和靶点蛋白上单一的结合表位亲和力评估,而直接法和间接法均是对候选药物和靶点蛋白整个结构的亲和力评估。
Ca2+,IP1,cAMP等第二信使的检测
Ca2+和荧光染料(Fluo-3AMA等)结合后被特定波长激发后有发射光产生,该发射光的强度和钙离子的浓度线性相关,整个是采用荧光方法检测基础,由于细胞收到刺激后其Ca2+浓度的变化是一个瞬时的过程,会在很短的时间内增加再回到基线值,对于Ca2+的检测是一个实时动态的过程,在整个实验过程中加样和检测都是需要控制在极短的时间内完成,Fluorescence Imaging Plate Reader FLIPR™ 技术和仪器是进行瞬时离子浓度变化检测的仪器,其自动化进样,微孔板模式,实时动态的检测过程能够通过控制候选药物和天然配体的加样顺序和浓度在一次实验中进行高通量的,候选药物的激动剂效果,增效剂效果和拮抗剂效果的检测,是研究离子通道和GPCR功能非常实用的技术。
IP1,cAMP等小分子第二信使一般可以通过ELISA,TR-FRET,偏振荧光等技术采用竞争法进行定量检测,市面上已有多个供应商提供相关试剂盒进行检测,需要说明的是采用竞争法进行检测需要加入IP1,cAMP的标准品建立标准曲线确定该试剂盒的线性检测范围,优化细胞的加入数目。很多知名的供应商官网上有比较详细的试剂盒说明书和方法优化方案可供学习,这里就不作详细讨论。
后续待进一步上传. . .
细胞的生理反应进程概述
细胞是生命活动的基本单位,以细胞为研究对象的功能学评价方法有别于在体外理想条件下的生物化学反应过程(蛋白间相互作用,酶催化反应)等,其生理反应进程为多阶段的,可能涉及到多个受体蛋白/信号通路,协同/拮抗的复杂过程。
细胞单一的生理反应进程,如下图模型所示,可分为四个方面:
- 以细胞膜的界限,细胞内蛋白或者膜受体和外界的分子结合,接收来自外界的信号。
- 接受信号的蛋白或者受体发上构象的改变,多聚化或者改变其和胞内其他蛋白的结合能力,通过第二信使或者激酶等将信号传导下去,并逐级放大。
- 放大的信号继续传递影响到下游的转导信号通路,影响到转录因子的活性,转录因子进入细胞核,介导核苷酸的转录,转录RNA进入细胞基质中调节蛋白的表达。
- 蛋白的丰度表达导致细胞对信号分子产生最终的响应,引起细胞向外界分泌物质,细胞增殖或者死亡。


细胞功能学评价方法的分类
根据细胞单一的生理反应进程可以将细胞的功能学检测方法分为以下4类:
1.测定候选药物引起靶点蛋白最初的变化,最常见的是候选药物和位于细胞膜上的靶点受体的结合,或者阻断靶点受体和天然配体的结合,常用的检测技术包括Cell-Basd ELISA,流式细胞术进行测定候选药物-受体偶联物。有别于将靶点受体重组纯化出来进行亲和力评价,细胞膜上的靶点受体更接近真实的生理情况,位于细胞上的其他受体,效应蛋白可能会参与靶点蛋白的激活变化过程,更有参考价值。而且很多膜蛋白是多透膜结构,很难纯化得到完整三级结构构象的受体蛋白(如G蛋白偶联受体为7透膜)。
2.测定信号转导过程中信号通路中关键生物标志物的浓度,如GPCR(G-蛋白偶联受体)激活过程中第二信使cAMP, DAG, IP3(TR-FRET,ELISA)和 Ca+2 (FLIPR)的测定;关键效应蛋白磷酸化等修饰的浓度(TR-FRET,WB);关键酶酶浓度的测定;动力学转运过程的测定(内化)等。
3.对引起细胞应答的转录和翻译水平的测定。如采用实时荧光定量PCR技术对转录RNA水平的测定;采用在启动子后面插入外源的报告基因测定转录因子的活性。
4.以整个细胞为对象测定细胞的增殖或者死亡(MTT.CCK-8,c,Alarmablue,ATP测定,LDH测定),细胞的蛋白组或者基因组变化(流式测定周期凋亡),细胞的转移迁移能力变化(划痕,侵袭,transwell实验),细胞分泌物的测定如PBMC细胞的TNF和IL定量测定(ELISA,TR-FRET)。
武汉合研生物医药科技有限公司在药物筛选领域拥有丰富的技术积累,能完成各种基于细胞水平的药物筛选技术服务。
将进行细胞单一的生理反应进程的各个阶段的四类功能学实验,即接收信号(靶点蛋白结合力),信号放大(第二信使或者激酶测定),转录翻译(RT-qPCR或者报告基因),最终响应(细胞死活检测,分泌物检测),搭建完整的药物刺激后细胞响应的网络,评估靶点的有效性。在药物筛选阶段,则需要根据实验操作便捷性,选择蛋白水平的结合实验(1类)或者细胞的死活(4类)来进行药物的初步高通量筛选。功能学评价阶段最重要的是对活性比较纯的候选药物的结合力水平(1类)和最终响应水平(4类)的评估和精确的数据展现,以待建立和动物实验结果的关联。质量控制阶段则是出于方法的稳定性和精密度的需求,选择纯化蛋白水平的结合力评估(4类)和细胞功能学评估方法(2,3,4类)以备放行需要。
G-蛋白偶联受体和ADCC效应的功能学评价方法
G-蛋白偶联受体是药物研发的主要靶点之一,截止2016年FDA审批通过的1286个药物中有460个是以G-蛋白偶联受体为靶点,占1/3以上,主流的仪器试剂供应商提供了以此靶点的细胞生理反应进程各个阶段的功能学评价方法。如下图所示,在G-蛋白偶联受体激活的细胞生理反应进程能够用于功能学评价的各个关键生物标志物。G-蛋白偶联受体被候选药物激活后,G-蛋白偶联受体的细胞内部分构型发生改变使得其和G蛋白的结合力增强,G蛋白和G-蛋白偶联受体结合后,其Gα亚基活性发生改变,使得Gα亚基更加容易和GTP结合,并从其两个亚基中解离出来,Gα亚基和GTP结合后根据其类型的不同改变不同效应蛋白的活性激活下游信号的级联反应,使得第二信使的浓度发生改变,第二信使的浓度发生改变激活后续的转录因子通路,转录因子的激活调节细胞的蛋白表达,发生细胞学响应。其中G-蛋白偶联受体激活后会磷酸化,β-arrestin和磷酸化的G-蛋白偶联受体结合后介导其内化,内化的G-蛋白偶联受体重新回到细胞表面或者进入溶酶体中降解,是G-蛋白偶联受体激活后的拮抗调节通路。

如上图所示如果按照上文所述的功能学评价的分类分为四类,以,,,进行区分,同一类别实验不同生物标志物的检测方法-1,-2等表示,以概述下主流的检测方法。
配体和受体的结合,细胞水平的亲和力评估实验。
在实际的应用过程中,特别是方法开发的初期,以细胞表面的蛋白为靶点的评价方法多采用Cell-Basd ELISA或者流式细胞技术进行亲和力测定,测定的模式可以多样,如直接法检测:将候选药物进行直接进行荧光标记检测,间接法检测:抗候选药物非靶点结合位点的荧光/酶联标记二抗进行检测(如抗人IgG1的Fc端兔抗体偶联HRP作为二抗),或者竞争法检测:将靶点蛋白的天然配体进行标记,加入候选药物进行竞争。一般来讲间接法检测和竞争法检测更具有通用性和可比性,适合多个候选药物同时进行筛选评价。需要说明的是竞争法检测针对的是候选药物和靶点蛋白上单一的结合表位亲和力评估,而直接法和间接法均是对候选药物和靶点蛋白整个结构的亲和力评估。
Ca2+,IP1,cAMP等第二信使的检测
Ca2+和荧光染料(Fluo-3AMA等)结合后被特定波长激发后有发射光产生,该发射光的强度和钙离子的浓度线性相关,整个是采用荧光方法检测基础,由于细胞收到刺激后其Ca2+浓度的变化是一个瞬时的过程,会在很短的时间内增加再回到基线值,对于Ca2+的检测是一个实时动态的过程,在整个实验过程中加样和检测都是需要控制在极短的时间内完成,Fluorescence Imaging Plate Reader FLIPR™ 技术和仪器是进行瞬时离子浓度变化检测的仪器,其自动化进样,微孔板模式,实时动态的检测过程能够通过控制候选药物和天然配体的加样顺序和浓度在一次实验中进行高通量的,候选药物的激动剂效果,增效剂效果和拮抗剂效果的检测,是研究离子通道和GPCR功能非常实用的技术。

IP1,cAMP等小分子第二信使一般可以通过ELISA,TR-FRET,偏振荧光等技术采用竞争法进行定量检测,市面上已有多个供应商提供相关试剂盒进行检测,需要说明的是采用竞争法进行检测需要加入IP1,cAMP的标准品建立标准曲线确定该试剂盒的线性检测范围,优化细胞的加入数目。很多知名的供应商官网上有比较详细的试剂盒说明书和方法优化方案可供学习,这里就不作详细讨论。
后续待进一步上传. . .